Artículo de revisión
Combinación de antibióticos carbapenémicos con relebactam sobre enterobacterias productoras de carbapenemasas
Combination of carbapenem antibiotics with relebactam on carbapenemase-producing Enterobacteriaceae
Washington Paúl Culqui Molina 1 * https://orcid.org/0000-0003-1025-0110
Martha Elizabeth Loor Flores 2 https://orcid.org/0009-0001-6955-6627
Mónica Viviana Moscoso Silva 1 https://orcid.org/0009-0007-1018-4180
1 Universidad Regional Autónoma de Los Andes, Ambato. Ecuador.
2 Hospital Universitario Vithas Madrid, España.
*Autor para la correspondencia: ua.washingtoncm67@uniandes.edu.ec
RESUMEN
Las enterobacterias productoras de carbapenemasas se han diseminado por todo el mundo y causan infecciones de alta mortalidad y morbilidad. Los antibióticos carbapenémicos se utilizan como último recurso frente a las infecciones graves producidas por estas bacterias, debido a los escasos efectos adversos y baja toxicidad. Sin embargo, su uso continuo ha dado lugar a fenómenos de resistencia como la producción de enzimas carbapenemasas y ha llevado a la búsqueda de combinaciones de estos antibióticos betalactámicos con inhibidores de carbapenemasas para ayudar a combatir este problema de salud pública. En este trabajo, se recopiló información comprendida entre 2015 y 2023, con el objetivo de conocer en España la frecuencia de los tipos de carbapenemasas producidas por enterobacterias y la actividad del inhibidor relebactam en combinación con antibióticos carbapenémicos frente a estas bacterias. En España, Klebsiella pneumoniae es la enterobacteria productora de carbapenemasa más frecuente (73,8 %) y KPC fue la carbapenemasa más abundante (45,11 %) en comparación con OXA-48 (42,29 %), VIM (13,23 %), y NDM (3,47 %). La adición del relebactam restaura prácticamente el 100% de la actividad de imipenem frente a las enterobacterias productoras de KPC. Escherichia coli y K. pneumoniae productoras de KPC, son inhibidas por la combinación de ertapenem y relebactam. El relebactam restaura la actividad de imipenem y ertapenem frente a enterobacterias productoras de KPC.
Palabras clave: carbapenemasas, relebactam, inhibidores betalactamasas, carbapenémicos
ABSTRACT
Carbapenemase-producing Enterobacteriaceae have spread throughout the world, causing infections of high mortality and morbility. Carbapenem antibiotics are used as a last option against serious infections caused by these bacteria, due to the few adverse effects and low toxicity. However, their continuous use has given rise to a resistence phenomena such as the production of carbapenemase enzymes and has led to the search for combinations of these beta-lactam antibiotics with carbapenemase inhibitors, to help combat this public health problem. In this work, information was collected between 2015 and 2023, to get better understanding of the frequency of different carbapenemases produced by Enterobacteriaceae found in Spain and the activity of relebactam inhibitor in combination with carbapenems against these bacteria. In Spain, Klebsiella pneumoniae was the most frequent carbapenem-producing Enterobacteriaceae (73.8 %) and KPC, the most common carbapenemase (45.11 %), when compared to OXA-48 (42.29 %), VIM (13.23 %) and NDM (3.47 %). The addition of relebactam restores almost 100% activity of imipenem against KPC-producing Enterobacteriaceae. KPC-producing Escherichia coli and K. pneumoniae are inhibited by the combination of ertapenem and relebactam. Relebactam restores the activity of imipenem and ertapenem against KPC-producing Enterobacteriaceae.
Keywords: carbapenemases, relebactam, beta-lactamase inhibitor, carbapenems
Recibido: 13/01/2025.
Aprobado: 12/03/2025.
Introducción
Los antibióticos betalactámicos constituyen uno de los grupos más importantes dentro de la terapéutica antiinfecciosa y continúan siendo el tratamiento de primera elección en numerosos procesos infecciosos. Los fármacos pertenecientes a este grupo tienen en común en su estructura química el anillo betalactámico, que resulta de la unión de alanina y β-dimetilcisteína. La asociación de diferentes tipos de cadenas lineales a este núcleo determina diferencias en la actividad antibacteriana y en las propiedades farmacocinéticas dando lugar a los diferentes grupos.(1,2)
Los betalactámicos actúan interfiriendo la síntesis de la pared bacteriana, concretamente inhiben la terminación del enlace cruzado de la pentaglicina, proceso catalizado por las enzimas, transpeptidasas y carboxipeptidasas. El sustrato de los betalactámicos son las proteínas fijadoras de penicilina (PBP), a las cuales se unen bloqueando su actividad, provocando que el microorganismo ponga en marcha un sistema de autolisinas (enzimas autolíticas de la pared celular), normalmente reprimido, que da lugar a la lisis de la bacteria.(1,2)
La eficacia de los distintos betalactámicos varía según la facilidad de penetración al interior de la bacteria, la afinidad por las PBP y la resistencia a las betalactamasas. Estos antibióticos no presentan toxicidad para las células humanas por actuar sobre una estructura exclusiva de las células procariotas, por lo que se pueden administrar a dosis elevadas durante periodos de tiempo prolongados. Entre los grupos de esta familia se incluyen las penicilinas, las cefalosporinas, los monobactámicos y los carbapenémicos.(2)
La aparición de microorganismos resistentes a los antibióticos betalactámicos se conoce desde la introducción de los antimicrobianos en la terapéutica en 1940 con la comercialización de la penicilina. La adquisición de resistencia puede originarse en el propio microorganismo, fruto de mutaciones o por la adquisición de material genético exógeno portador de genes de resistencia. Los mecanismos por los que una bacteria puede adquirir resistencia a los betalactámicos son:(1,2)
1) Producción de betalactamasas, enzimas que se excretan al espacio periplásmico, donde hidrolizan al antibiótico o lo modifican inactivándolo, impidiendo que alcance a las PBP. Pueden estar codificadas en cromosomas o adquiridas a través de plásmidos y pueden ser constitutivas o inducibles. Se han clasificado de acuerdo con su especificidad por el sustrato (penicilasas, cefalosporinas o carbapenemasas), la clase molecular (A, B, C, D), la susceptibilidad a inhibidores (ácido etilendiaminotetraacético EDTA y ácido clavulánico) y la localización genética (plasmídica o cromosómica). El espectro de actividad es variable: las betalactamasas de espectro reducido son activas frente a las penicilinas y sensibles al ácido clavulánico; las betalactamasas de espectro extendido (BLEE) son activas frente a los betalactámicos, excepto los carbapenémicos y cefamicinas y sensibles al ácido clavulánico; las betalactamasas de clase C no son inhibidas por el ácido clavulánico, y confieren resistencia a los betalactámicos excepto cefalosporinas de cuarta generación y carbapenémicos; y las carbapenemasas que actúan sobre los carbapenémicos pero pueden conferir resistencia a todos los betalactámicos. Este es el mecanismo más frecuente en bacterias gramnegativas.
2) Modificaciones de la diana: la resistencia suele producirse por mutaciones que modifican las PBP y pierden afinidad para el betalactámico, o por la adquisición de fragmentos exógenos de DNA, incorporados por transformación, provenientes de otras bacterias que codifican PBP con baja afinidad por los betalactámicos. Este mecanismo es más frecuente en bacterias grampositivas.
3) Disminución de la permeabilidad: las enterobacterias y Pseudomonas aeruginosa pueden presentar resistencia a los betalactámicos por pérdida o disminución de la expresión de porinas, que son proteínas de la membrana externa de bacterias gramnegativas que forman canales por los que penetran diferentes nutrientes y otras sustancias.
4) Activación de sistemas de expulsión del antibiótico hacia el exterior de la célula. Estos sistemas de expulsión son complejos proteicos que detoxifican diversas sustancias nocivas para la célula bacteriana.
La importancia del conocimiento de los mecanismos de resistencia a los antibióticos en este tipo de infección nos determina como objetivo de la presente investigación: conocer en España la frecuencia de los tipos de carbapenemasas producidas por enterobacterias y la actividad del inhibidor relebactam en combinación con antibióticos carbapenémicos frente a estas bacterias.
Método
Se llevó a cabo una revisión bibliográfica en la plataforma PudMed, Pubchem, SCOPUS y SciELO. Se priorizó la búsqueda de información sobre inhibidores de carbapenemasas, en concreto el relebactam.
Las palabras claves que ayudaron en la búsqueda fueron: carbapenemasas, relebactam, inhibidores betalactamasas, carbapenémicos, KPC, OXA, NDM, en castellano y en inglés. También se incluyeron en la búsqueda algunos autores por ejemplo Cantón, R., Culebras, E. o Rodríguez-Avial, I. Se acotó la búsqueda a un rango de antigüedad desde el 2015 al 2023 de las publicaciones.
Desarrollo
Antibióticos carbapenémicos
Presentan el más amplio espectro de actividad de todos los antibióticos betalactámicos, abarcando bacterias grampositivas y gramnegativas aerobias y anaerobias. Se absorben poco por vía oral y requieren administración parenteral y se consideran el fármaco de elección en infecciones graves resistentes a múltiples fármacos y complicadas. Todos los antibióticos de esta familia atraviesan la barrera placentaria y alcanzan concentraciones en la circulación fetal, pero debido a su escasa toxicidad no están contraindicados durante la gestación.(1) Presentan una gran resistencia a la gran mayoría de las betalactamasas tanto cromosómicas como plasmídicas.
Se caracterizan porque el anillo betalactámico se encuentra unido a un anillo de cinco componentes insaturado y que contiene un átomo de carbono en sustitución del átomo de azufre típico de las penicilinas. Dentro de este grupo se encuentran: imipenem, meropenem, ertapenem y doripenem.(1)
El imipenem es el más utilizado y el más activo frente a grampositivos (Enterococcus faecalis) y el meropenem y doripenem frente a algunos gramnegativos (Pseudomonas spp.). El ertapenem presenta escasa actividad frente a P. aeruginosa, Acinetobacter spp., y otros bacilos gramnegativos no fermentadores y enterococos. El imipenem se inactiva rápidamente por la enzima deshidropeptidasa I renal (DHP-1), por lo que se administra en combinación con cilastatina, un inhibidor de DHP-I que aumenta la vida media y la penetración en los tejidos.(1)
La resistencia a los carbapenémicos puede ser causada por una reducida permeabilidad de la membrana externa, sobreexpresión de las bombas de salida o producción de carbapenemasas(3). La producción de carbapenemasas es el principal mecanismo de resistencia de las enterobacterias y reciben este nombre por ser un grupo de betalactamasas con alta eficiencia catalítica para la hidrólisis de carbapenémicos y de todos los betalactámicos.(4) Se agrupan en tres clases: A, B y D según la clasificación molecular de Ambler, en función de los mecanismos de interacción enzima-sustrato y la secuencia de aminoácidos de las betalactamasas; y se corresponden respectivamente con los grupos funcionales 2f, 3 y 2df de la clasificación de Bush y Jacoby del año 2010.(3,5,6)
En la tabla I se recogen las carbapenemasas más frecuentes a nivel mundial, que se describirán más adelante.
Tabla I. Algunos de los tipos más frecuentes de carbapenemasas, los antibióticos betalactámicos a los que es resistente, el tipo de microorganismo en el que se describe y el origen de la carbapenemasa.

*ERTA: ertapenem, IMI: imipenem, MERO: meropenem. ND: dato no disponible.
Clase A: La clase A o serina carbapenemasas tienen un resto de serina en el centro activo y son inhibidas por el ácido clavulánico. Incluyen las enzimas SME, IMI, NMC, codificadas en el cromosoma y las enzimas GES y KPC, codificadas en plásmidos. Las que mayor importancia epidemiológica tienen son las KPC que reciben este nombre por haberse encontrado inicialmente en Klebsiella pneumoniae (KPC = K. pneumoniae carbapenemasa). Se informaron por primera vez en 1996 en Estados Unidos y se han extendido a través de países y continentes, siendo KPC-1 y KPC-2 las descritas con mayor frecuencia.(3,4,5,8,11)
Clase B: Las enzimas de la clase B o metalo-β-lactamasas (MBL) dependientes de zinc, tienen una o dos moléculas de zinc en su zona activa, son inhibidas por agentes quelantes, como el EDTA, por compuestos tiólicos como el 2-mercaptopropiónico o el ácido dipicolínico. Las principales MBL son NDM (Nueva Delhi Metallo β-lactamasa), IMP (Activa en imipenem) y VIM (Verona Integron-codificado Metalo β-lactamasa) las tres de naturaleza plasmídica. NDM fue descrita por primera vez en 2009, en un aislado de cultivo urinario de K. pneumoniae de un paciente sueco que había viajado a la India y desde entonces se han identificado 24 variantes a nivel mundial(7,11). En España, la primera descripción de carbapenemasas en enterobacterias fue una VIM-1 en 2005(13), y es endémica de Grecia e Italia.(11)
Clase D: Son serina carbapenemasas ya que tienen un resto de serina en el centro activo y son inhibidas por el ácido clavulánico. Son enzimas del grupo de las oxacilinasa (OXA) que se caracterizan por hidrolizar oxacilina y algunas variantes hidrolizan los carbapenémicos. Las principales variantes son OXA-23, OXA-24, OXA-58, OXA-143 y OXA-51, descritas en Acinetobacter spp., y sobre todo la OXA-48, producida mayormente por K. pneumoniae. OXA-48 es de naturaleza plasmídica y se informó por primera vez en 2003 en Turquía. Desde entonces se ha descrito en todo el mundo con una prevalencia creciente en países mediterráneos. La amplia distribución puede deberse a que el gen que codifica esta enzima generalmente se encuentra en un plásmido altamente transferible que es capaz de propagarse entre varios clones, así como entre varias especies de Enterobacteriaceae (3,6,10) Las infecciones con enterobacterias productoras de carbapenemasas causan hospitalización prolongada, alta mortalidad y morbilidad, se han convertido en un problema clínico y de salud pública emergente, en continua evolución.(3,12)
Inhibidores de carbapenemasas
Los inhibidores de las betalactamasas son moléculas con estructura betalactámica, de baja actividad, pero sensibles a las enzimas betalactamasas. Si se emplean en combinación con antibióticos betalactámicos de uso clínico, las betalactamasas se unirán a los inhibidores, evitando así su fijación a los betalactámicos activos. Los inhibidores más usados son el ácido clavulánico, el tazobactam y el sulbactam y se emplean frecuentemente asociados a penicilinas y aminopenicilinas.(1)
Recientemente se han descrito otros inhibidores con una estructura no betalactámica y un espectro de actividad más amplio por ser activos frente a enzimas carbapenemasas. El vaborbactam es un derivado del ácido borónico que tiene una alta afinidad por los residuos de serina, lo que le permite servir como un inhibidor de la carbapenemasas de clase A, como KPC.(14) Avibactam y relebactam tienen estructura de diazobiciclooctano y son activos frente a carbapenemasas de clase A, C y D.(15,16,17) Estos inhibidores se utilizan en combinación con los distintos antibióticos carbapenémicos o cefalosporinas, aunque aún existen pocos datos de su eficacia. La tabla II recoge algunas de estas combinaciones y las enterobacterias frente a las que se han estudiado.
Tabla II. Combinaciones de betalactámicos con inhibidores y el tipo de carbapenemasa sobre la que ejercen su acción.
|
Citas |
β-lactámicos + Inhibidor |
Tipo de enzima que inhiben |
Microorganismos (Nº cepas) |
|
O’Donnell(15), 2022. |
Imipenem-relebactam |
KPC (clase A) |
Enterobacterias productoras de carbapenemasas |
|
Noval (14), 2020. |
Ceftazidima-avibactam |
*Clase A. *Clase C. OXA-48 (clase D). |
Enterobacterias productoras de carbapenemasas |
|
Meropenem-vaborbactam |
KPC (clase A). Clase C. |
||
|
Imipenem-relebactam |
KPC (clase A). AmpC (clase C). |
||
|
Cefiderocol |
Clase A. Clase B (MBL). Clase C. Clase D. |
||
|
Hafi (18), 2019. |
Ertapenem, Meropenem, imipenem con Avibactam |
OXA-48. |
E. coli (2) K. pneumoniae (3) |
|
Ertapenem, Meropenem, imipenem con EDTA |
NDM. |
K. pneumoniae (2) |
|
|
Ertapenem, Meropenem, imipenem con Relebactam |
KPC-2. |
Salmonella spp. (1) |
|
|
Papp-Wallace (19), 2018. |
Imipenem-Relebactam |
KPC-2.
|
K. pneumoniae (84), K. oxytoca (1), Enterobacter cloacae (6), E. aerogenes (3), Citrobacter freundii (2), C. koseri (1) y E. coli (4) |
|
Zhanel (16), 2017. |
Imipenem- relebactam |
Clase A (KPC, incluyendo ͌BLEE) Clase C (AmpC). |
Enterobacter spp. (142), K. pneumoniae (51), E. coli (8). |
|
Meropenem- vaborbactam |
*Clase A, B, C, D = enzimas que pertenecen a la clasificación Ambler, BLEE= Betalactamasa de espectro extendido.
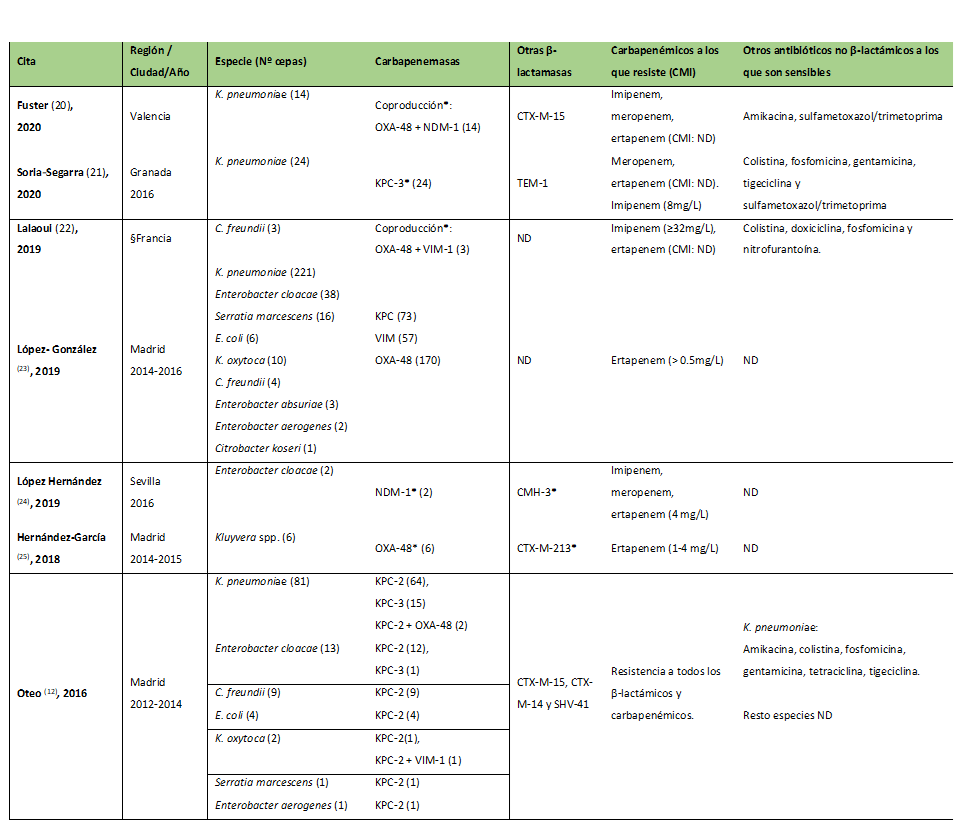
Enterobacterias productoras de carbapenemasas en España
En la tabla III se muestran los siete estudios analizados, que recogen un total de 461 cepas aisladas desde 2012. Se observa que Klebsiella pneumoniae es la especie más frecuente (73,8 % de las cepas) seguida de Escherichia coli y de los géneros Enterobacter, Citrobacter y Serratia.
Tabla III. Situación de las enterobacterias productoras de carbapenemasas en España.
Actividad de relebactam en combinación con carbapenémicos en enterobacterias
Se ha realizado una búsqueda bibliográfica, acerca de la combinación del relebactam con ertapenem, imipenem y meropenem, los resultados se muestran en la tabla IV y se representan en la figura 1.
Tabla IV. Estudios realizados sobre el efecto provocado al combinar con relebactam los distintos carbapenémicos. Se indica el porcentaje de susceptibilidad in vitro de cada una de las cepas ensayas con el carbapenémico con y sin inhibidor.
|
Especie (Nº cepas) |
Carbapenemasa (Nº cepas) |
Otras β-lactamasa |
% Susceptibilidad |
||||||
|
IMI |
IMI+ Inh |
ERTA |
ERTA+ Inh |
MERO |
MERO+ Inh |
||||
|
Johnston (26), 2020. |
E. coli (203) |
KPC (35) |
CTX-M (84) CMY-2 (58) |
0% |
100% |
0% |
- |
54% |
- |
|
NDM (16) |
0% |
6% |
6% |
6% |
|||||
|
OXA-48(9) |
11% |
67% |
0% |
78% |
|||||
|
Karlowsky (27), 2020. |
E. coli (11) |
No presenta |
No presenta |
0% |
90,9% |
0% |
- |
0% |
- |
|
K. pneumoniae (62) |
0% |
85,5% |
0% |
- |
0% |
- |
|||
|
Lob (28), 2020. |
E. coli (5) |
KPC |
± BLEE ± AmpC |
0% |
100% |
-
|
- |
-
|
- |
|
K. pneu-moniae (156) |
OXA-48 (22) + KPC (130) |
± BLEE ± AmpC |
0% |
100% |
|||||
|
E. cloacae (9) |
KPC (1) |
No presenta |
0% |
100% |
|||||
|
S. marcescens (9) |
MBL (5) + OXA-48 (1) |
No presenta |
0% |
10% |
|||||
|
S. marcescens (20) |
No presenta |
BLEE |
0% |
100% |
|||||
|
K. aerogenes (4) |
KPC |
No presenta |
0% |
100% |
|||||
|
C. freundii (2) |
KPC |
No presenta |
0% |
100% |
|||||
|
K. oxytoca (2) |
KPC |
No presenta |
0% |
100% |
|||||
|
E. kobei (1) |
KPC |
No presenta |
0% |
100% |
|||||
|
E. coli (15) |
MBL |
No presenta |
0% |
0% |
|||||
|
K. pneu-moniae (194) |
MBL (79) + OXA-48 (112) + KPC (1) |
± BLEE ± AmpC |
0% |
0% |
|||||
|
E. cloacae (40) |
MBL (39) + OXA-48 (1) |
± BLEE ± AmpC |
0% |
0% |
|||||
|
K. aerogenes (3) |
MBL + OXA-48+KPC |
No presenta |
0% |
0% |
|||||
|
K. oxytoca (3) |
MBL + OXA-48+KPC |
No presenta |
0% |
0% |
|||||
|
S. lique-faciens (3) |
MBL + OXA-48+KPC |
No presenta |
0% |
0% |
|||||
|
C. freundii (2) |
MBL + OXA-48+KPC |
No presenta |
0% |
0% |
|||||
|
E. absuriae (1) |
MBL + OXA-48+KPC |
No presenta |
0% |
0% |
|||||
IMI: imipenem. ERTA: ertapenem. MERO: meropenem. S: sensibles. Inh: Inhibidor. –: no se presentan datos por los autores.
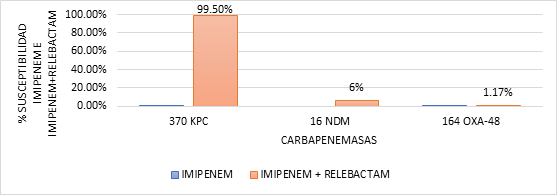
Figura 1. Porcentaje de susceptibilidad de imipenem e imipenem con relebactam en función de los tipos de carbapenemasas indicadas en los distintos trabajos que se muestran en la tabla IV.
Como se puede observar en la tabla IV, donde se recoge información acerca de los antibióticos carbapenémicos frente a los que presentan resistencia las enterobacterias estudiadas en distintas publicaciones, los datos son similares a los encontrados en otros países europeos, según recoge el estudio de seguimiento de enterobacterias productoras de carbapenemasas (EuSCAPE).(30) Los datos comunicados por los laboratorios centinela de 36 países en los años 2013 y 2014 revelaron que el 85 % de las cepas resistentes correspondían a K. pneumoniae y 15 % a E. coli y que existe diferencias de prevalencia entre países, siendo significativamente más alta en los mediterráneos y balcánicos.
En España, mientras que las tasas de E. coli resistentes a carbapenémicos se mantienen estables por debajo del 1%, las cepas de K. pneumoniae productoras de carbapenemasas han aumentado de forma preocupante desde el año 2000, pasando de <1 % a 3,8 % en 2018. Aun así, se mantiene muy por debajo las tasas encontradas en Italia (25-50 %) y Grecia (hasta 75 %) (31). Las enterobacterias productoras de carbapenemasas no son sin embargo el grupo que presenta mayor tasa de cepas productoras de carbapenemasas en España, ya que otros bacilos Gram negativos poseen porcentajes más elevados: Pseudomonas aeruginosa (20,7 %) y Acinetobacter baumanii con un 68,2 % de cepas resistentes.(31,32)
Los carbapenémicos más estudiados y frente a los que se detectan más resistencias son imipenem, meropenem y ertapenem. Algunos autores (10,17,33), señalan que la resistencia al ertapenem es común y un buen indicador de la presencia de KPC, y que OXA-48 confiere mayor actividad catalítica para imipenem. Las cepas productoras de carbapenemasas, además de presentar resistencia a carbapenémicos lo son también a otros antibióticos betalactámicos o prácticamente a todos ellos.(12) Esto se debe a que los genes que codifican las enzimas betalactamasas de distintos tipos suelen estar incluidos en plásmidos y se transmiten conjuntamente.(20,34)
Puede verse en la tabla IV, datos de la coproducción de varias carbapenemasas y otras betalactamasas. Algunas de las cepas estudiadas de K. pneumoniae, K. oxytoca y C. freundii son coproductoras de varias carbapenemasas (OXA-48 + NDM-1, OXA-48 + VIM-1, OXA-48 + KPC-2 o KPC-2 + VIM-1) y una alta proporción de los aislados de K. pneumoniae producían además otras enzimas betalactamasas (CTX-M-15). Esto puede afectar a la CMI.(17,33) Por ejemplo, llama la atención el valor muy alto de C. freundii, de CMI >32 mg/L para imipenem que podría ser debido a que las cepas son productoras de dos tipos de carbapenemasas OXA-48 y VIM, frente a valores menores de CMI (8 mg/L) para imipenem, en las cepas con un solo tipo de enzima.(22)
En algunos de los trabajos consultados se ha estudiado también la susceptibilidad frente a otros antibióticos no betalactámicos: aminoglucósidos (amikacina, gentamicina), fosfomicina, glicilciclina (tigeciclina), nitrofuranos (nitrofurantoina), polimixinas (colistina), sulfonaminas (sulfametoxazol), tetraciclina (doxiciclina, tetraciclina). En los datos de la tabla VI, se observa que la fosfomicina presentaría buena actividad frente a muchas de las enterobacterias productoras de carbapenemasas, así como los aminoglucósidos (amikacina y gentamicina).
En relación con los aminoglucósidos la resistencia está aumentando entre las bacterias productoras de KPC, los datos in vitro indican una rápida actividad bactericida contra cepas susceptibles a gentamicina; se ha discutido el uso de otros antimicrobianos más antiguos como la fosfomicina o la nitrofurantoína en infecciones como las del tracto urinario.(17) Muchas de las cepas de K. pneumoniae y C. freundii resultaron sensibles a la colistina, como se ha descrito también en otros estudios.(12,21,22) Sin embargo, la colistina presenta una alta nefrotoxicidad y neurotoxicidad por lo que su uso es restringido a infecciones complicadas por bacterias multirresistentes.
La tigeciclina es una nueva glicilciclina que se usa en el tratamiento de infecciones causadas por bacterias productoras de KPC y otras bacterias gramnegativas multirresistentes. Tiene excelente actividad in vitro, aunque está asociada con el aumento en la resistencia a la tigeciclina en Klebsiella spp.(17) La plazomicina es un nuevo aminoglucósido aprobado en EE. UU, aunque aún no en Europa, con buena actividad para el tratamiento de infecciones por enterobacterias resistentes a carbapenémicos.(35)
En la fig. 1, podemos observar que la enzima KPC es la más abundante (45,11 %) en relación con la OXA-48 (42,29 %), VIM (13,23 %) y NDM (3,47 %). Estos porcentajes indican un aumento significativo de la enzima KPC, aunque en el estudio publicado por el European Centre for Disease Prevention and Control (ECDC) de 2014, la enzima más prevalente era OXA-48 (en torno al 70 %, mientas que KPC suponía apenas un 10 %), esto puede coincidir con estudios publicados en España, en los que se indica que las enterobacterias productoras de carbapenemasas se habían dispersado en todo el país con un predominio de aislamientos de K. pneumoniae productores de OXA-48; pero con una prevalencia creciente de productores de KPC y mantenimiento de productores de VIM. Respecto a NDM, desde los primeros casos importados en 2010 hasta la actualidad sigue representando un porcentaje bajo de un 3,47 % en comparación con la KPC, OXA-48 y VIM-1.(32,36)
Respecto a la tabla IV, el empleo de inhibidores de carbapenemasas es muy reciente, por lo que existen pocos datos en la bibliografía que hagan referencia a su actividad en enterobacterias productoras de carbapenemasas. En la tabla, se recogen resultados en total de 953 cepas: 602 cepas de K. pneumoniae, 238 de E. coli y un menor número de cepas de otras especies de Enterobacter (57), Serratia (32), Klebsiella (16), Citrobacter (7) y Salmonella (1). Todas las cepas eran productoras de carbapenemasas (datos no mostrados en Karlowsky,(27) y prácticamente el 100 % eran resistentes a imipenem. El ertapenem y el meropenem solo se estudiaron en tres trabajos, y prácticamente el 99 % de las cepas fueron resistentes a ertapenem y el 77 % resistentes a meropenem.(18,26,27) Se puede notar que la combinación de carbapenémicos con relebactam se analiza mayoritariamente con imipenem y que la adición del relebactam restaura prácticamente el 100% la actividad del imipenem, excepto en las cepas productoras de MBL. Estudios de combinación de relebactam con ertapenem y meropenem solo existe uno, además con imipenem, donde se encuentra que todas las cepas ensayadas fueron inhibidas por los antibióticos en combinación con el inhibidor; mientras que eran resistentes en presencia solo del carbapenémico.(18)
Las especies mayormente estudiadas son E. coli y K. pneumoniae y las carbapenemasas, que aparecen con más frecuencia en todas las enterobacterias investigadas son KPC, NDM y OXA-48. En este sentido, podemos observar que existe una relación entre la carbapenemasa presente y el efecto causado cuando se combina el antibiótico con el relebactam (tabla IV). De manera general, se observa que el relebactam restaura la actividad del imipenem en un 99,5 % frente a cualquier enterobacteria productora de KPC; pero no se observa este efecto cuando la carbapenemasa presente es la NDM o la OXA-48. Cuando están presentes NDM y OXA-48, la susceptibilidad de las enterobacterias productoras de dichas enzimas frente a la combinación del imipenem con relebactam es prácticamente nula, es decir, no cambia su fenotipo de resistencia.
Asociadas a estas enzimas aparecen en muchos casos otras betalactamasas como ESBL o AmpC, sin embargo, no influyen en el efecto causado por la combinación del inhibidor con imipenem. Esto corresponde con lo descrito en la bibliografía en donde se observa que el relebactam confiere resistencia frente a la actividad de las betalactamasas de la clase A de Ambler, incluidas las betalactamasas de espectro extendido (BLEEs), Klebsiella pneumoniae carbapenemasas (KPC) y betalactamasas de clase C (AmpCs). Sin embargo, no inhibe las metalo-betalactamasas (MBL) de la clase B, o carbapenemasas similares a OXA-48 de la clase D.(28)
La combinación imipenem con relebactam fue aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA), en julio de 2019, para pacientes con opciones limitadas para el tratamiento de la infección intraabdominal complicada y la infección complicada del tracto urinario, incluida la pielonefritis, causada por bacilos gramnegativos aerobios y anaerobios susceptibles. Recientemente se ha completado un estudio de Fase III de la combinación imipenem con relebactam para el tratamiento de pacientes con neumonía bacteriana, incluida la neumonía adquirida en el hospital.(27)
Conclusiones
En el período 2015 al 2023, se ha observado el incremento en la proporción de enterobacterias productoras de carbapenemasas, donde la KPC es la más prevalente en toda la geografía española, seguida de OXA-48. Se ha comprobado la restauración de la actividad del carbapenémico imipenem, cuando se combinó con el relebactam frente a cepas de enterobacterias productoras de KPC resistentes, lo que demuestra que es un inhibidor efectivo de esta carbapenemasa de clase A de la clasificación molecular de Ambler. La combinación de Imipinem/relebactam puede desempeñar un papel fundamental en el tratamiento de infecciones producidas por estas bacterias. Las enterobacterias productoras de OXA-48, VIM, NDM, permanecieron resistentes frente a la combinación imipenem con relebactam.
Referencias bibliográficas
1. Lorenzo P, Moreno A, Leza JC , Lizasoain I, Moro MA, Portolés Velázquez A. Farmacología Básica y Clínica. Buenos Aires: Editorial Médica Panamericana S.A;2018.
2. Prats G. Microbiología y Parasitología Médica. Buenos Aires : Editorial Médica ;2019.
3. Ciftci E, Cetin E, Us E, Kutlu HH, Aridogan BC. Investigation of Carbapenem resistance mechanisms in Klebsiella pneumoniae by using phenotypic tests and a molecular assay. J Infect Dev Ctries. 2019;13(11):992–1000.
4. Queenan AM, Bush K. Carbapenemases: The versatile β-lactamases. Clin Microbiol Rev. 2007;20(3):440–58.
5. Blázquez Garrido RS, Cuchí Burgos E, Martín Salas C, Ruiz-Garbajosa P. Métodos microbiológicos para la monitorización de la limpieza, desinfección y esterilización de
dispositivos médicos .En: Procedimientos en microbiología clínica.España:SEIMC; 2006 Available from: https://acici.cat/wp-content/uploads/2023/05/seimc-procedimientomicrobiologia.pdf
6. Goodman KE, Simner PJ, Tamma PD, Milstone AM. Infection control implications of heterogeneous resistance mechanisms in carbapenem-resistant Enterobacteriaceae (CRE). Expert Rev Anti Infect Ther [Internet]. 2016 [citado 18 feb 2025];14(1):95–108. Available from: https://www.tandfonline.com/doi/full/10.1586/14787210.2016.1106940
7. Li J, Yu T, Tao XY, Hu YM, Wang HC, Liu JL, et al. Emergence of an NDM-5-producing Escherichia coli sequence type 410 clone in infants in a children’s hospital in China. Infect Drug Resist. 2020;13:703–10.
8. Liu J, Zhang L, Pan J, Huang M, Li Y, Zhang H, et al. Risk Factors and Molecular Epidemiology of Complicated Intra-Abdominal Infections With Carbapenem-Resistant Enterobacteriaceae: A Multicenter Study in China. J Infect Dis. 2020;221(2):S156–63.
9. Tayh G, Nagarjuna D, Sallem R Ben, Verma V, Chairat S, Boudabous A, et al. First report of vim metallo-β-lactamase production in escherichia coli and klebsiella pneumoniae clinical isolates from gaza strip, palestine. Germs. 2020;10(1):18–26.
10. Galani I, Nafplioti K, Chatzikonstantinou M, Souli M. In vitro evaluation of double-carbapenem combinations against oxa-48-producing Klebsiella pneumoniae isolates using time-kill studies. J Med Microbiol. 2018;67(5):662–8.
11. Martin RM, Bachman MA. Colonization, infection, and the accessory genome of Klebsiella pneumoniae. Front Cell Infect Microbiol. 2018;8(JAN):1–15.
12. Oteo J, Calbo E, Rodríguez-ba J, Ruiz-garbajosa P, Horcajada JP, Luis J, et al. La amenaza de las enterobacterias productoras de carbapenemasas ˜ documento de posicionamiento de los grupos de estudio en Espana : GEIH y GEMARA de la SEIMC. 2014;32(10):666–70.
13. Tórtola MT, Lavilla S, Miró E, González JJ, Larrosa N, Sabaté M, et al. First detection of a carbapenem-hydrolyzing metalloenzyme in two Enterobacteriaceae isolates in Spain. Antimicrob Agents Chemother. 2005;49(8):3492–4.
14. Noval M, Banoub M, Claeys KC, Heil E. The Battle Is on: New Beta-Lactams for the Treatment of Multidrug-Resistant Gram-Negative Organisms. Curr Infect Dis Rep. 2020;22(1):1–9.
15. J. Nicholas O’Donnell a TPL aDepartment. New Perspectives on Antimicrobial Agents: Maribavir. New Perspect Antimicrob Agents Imipenem- Relebactam. 2022;66(9):1–19.
16. Zhanel GG, Lawrence CK, Adam H, Schweizer F, Zelenitsky S, Zhanel M, et al. Imipenem–Relebactam and Meropenem–Vaborbactam: Two Novel Carbapenem-β-Lactamase Inhibitor Combinations. Drugs. 2018;78(1):65–98.
17. Arnold RS, Thom KA, Sharma S, Phillips M, Kristie Johnson J, Morgan DJ. Emergence of Klebsiella pneumoniae carbapenemase-producing bacteria. South Med J. 2011;104(1):40–5.
18. Hafi El, Rasheed SS, Abou Fayad AG, Araj GF, Matar GM. Evaluating the efficacies of carbapenem/β-lactamase inhibitors against carbapenem-resistant gram-negative bacteria in vitro and in vivo. Front Microbiol. 2019;10(APR):1–13.
19. Papp-Wallace KM, Barnes MD, Alsop J, Taracila MA, Bethel CR, Becka SA, et al. Relebactam is a potent inhibitor of the kpc-2 -lactamase and restores imipenem susceptibility in kpc-producing enterobacteriaceae. Antimicrob Agents Chemother. 2018;62(6):1–9.
20. Fuster B, Tormo N, Salvador C, Gimeno C. Detection of two simultaneous outbreaks of Klebsiella pneumoniae coproducing OXA-48 and NDM-1 carbapenemases in a tertiary-care hospital in Valencia, Spain. New Microbes New Infect [Internet]. 2020[citado 18 feb 2025];34:100660. Available from: https://www.sciencedirect.com/science/article/pii/S2052297520300123
21. Soria-Segarra C, González-Bustos P, López-Cerero L, Fernández-Cuenca F, Rojo-Martín MD, Fernández-Sierra MA, et al. Tracking KPC-3-producing ST-258 Klebsiella pneumoniae outbreak in a third-level hospital in Granada (Andalusia, Spain) by risk factors and molecular characteristics. Mol Biol Rep [Internet]. 2020[citado 18 feb 2025];47(2):1089–97. Available from: https://pubmed.ncbi.nlm.nih.gov/31792747/
22. Lalaoui R, Djukovic A, Bakour S, Hadjadj L, Sanz J, Salavert M, et al. Genomic characterization of Citrobacter freundii strains coproducing OXA-48 and VIM-1 carbapenemase enzymes isolated in leukemic patient in Spain. Antimicrob Resist Infect Control. 2019;8(1):4–9.
23. López-González L, Viñuela-Prieto JM, Rodriguez-Avial I, Manzano R, Candel FJ. Description of carbapenemase-producing enterobacteriaceae isolates in a Spanish tertiary hospital. Epidemiological analysis and clinical impact. Rev Esp Quimioter. 2019;32(3):254–62.
24. López-Hernández I, García Barrionuevo A, Díaz de Alba P, Clavijo E, Pascual A. Characterization of NDM-1- and CMH-3-producing Enterobacter cloacae complex ST932 in a patient transferred from Ukraine to Spain. Enferm Infecc Microbiol Clin [Internet]. 2019;(xx). Available from:
https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-articulo-characterization-ndm-1-cmh-3-producing-enterobacter-cloacae-S0213005X19302976
25. Hernández-García M, León-Sampedro R, Pérez-Viso B, Morosini MI, López-Fresneña N, Diaz-Agero C, et.al. First Report of an OXA-48- and CTX-M-213-Producing Kluyvera Species Clone Recovered from Patients Admitted in a University Hospital in Madrid, Spain. 2018;62(11):1–10
26. Johnston BD, Thuras P, Porter SB, Anacker M, VonBank B, Vagnone PS, et al. Activity of imipenem-relebactam against carbapenem-resistant Escherichia coli isolates from the United States in relation to clonal background, resistance genes, coresistance, and region. Antimicrob Agents Chemother. 2020;64(5):1–23
27. Karlowsky J, Lob S, Raddatz J, DePestel D, Young K, Motyl M, Sahm D. In Vitro Activity of Imipenem/Relebactam and Ceftolozane/Tazobactam against Clinical Isolates of Gram-Negative Bacilli with Difficult-to-Treat Resistance and Multidrug Resistant Phenotypes – SMART United States 2015-2017. Infect Dis Soc Am. 2020;53(9):1689–99
28. Lob SH, Karlowsky JA, Young K, Motyl MR, Hawser S, Kothari ND, et al. In vitro activity of imipenem-relebactam against resistant phenotypes of Enterobacteriaceae and Pseudomonas aeruginosa isolated from intraabdominal and urinary tract infection samples - SMART Surveillance Europe 2015-2017. J Med Microbiol. 2020;69(2):207–17
29. Canver M, Satlin M, Westblade L, Kreiswirth B, Chen L, Robertson A, et.al. Activity of imipenem-relebactam and comparator agents against genetically characterized isolates of carbapenem-resistant Enterobacteriaceae. Antimicrob Agents Chemother. 2019;63(9):1–5
30. Grundmann H, Glasner C, Albiger B, Aanensen DM, Tomlinson CT, Andrasević AT, et al. Occurrence of carbapenemase-producing Klebsiella pneumoniae and Escherichia coli in the European survey of carbapenemase-producing Enterobacteriaceae (EuSCAPE): a prospective, multinational study. Lancet Infect Dis. 2016;17(2):153–63
31. ECDC. Surveillance Atlas of Infectious Diseases [Internet]. 2020. Available from: https://atlas.ecdc.europa.eu/public/index.aspx
32. Sánchez-López J, Cantón R. Current status of ESKAPE microorganisms in Spain: Epidemiology and resistance phenotypes. Rev Esp Quimioter. 2019;32:27–31
33. Woodford N, Dallow JWT, Hill RLR, Palepou MFI, Pike R, Ward ME, et al. Ertapenem resistance among Klebsiella and Enterobacter submitted in the UK to a reference laboratory. Int J Antimicrob Agents. 2007;29(4):456–9
34. Ding L, Shen S, Chen J, Tian Z, Shi Q, Han R, et al. Klebsiella pneumoniae carbapenemase variants: the new threat to global public health. Clin Microbiol Rev. 2023;36(4)
35. López-diaz MC, Culebras E, Rodríguez-avial I, Rios E, Viñuela-prieto JM, Picazo JJ. crossm Modifying Enzymes. 2017;61(2):1–4
36. Oteo J, Pérez-Vázquez M, Bautista V, Ortega A, Zamarrón P, Saez D, et al. The spread of KPC-producing Enterobacteriaceae in Spain: WGS analysis of the emerging high-risk clones of Klebsiella pneumoniae ST11/KPC-2, ST101/KPC-2 and ST512/KPC-3. J Antimicrob Chemother. 2016;71(12):3392–9
Conflicto de intereses
Los autores no declaran conflicto de intereses
Contribución de autoría
Todos los autores participaron de igual forma en los aspectos de la contribución de autoría.
![]() Esta
obra está bajo una licencia de Creative Commons Reconocimiento-
Esta
obra está bajo una licencia de Creative Commons Reconocimiento-